Bem-vindo à Associação de Leucodistrofia Metacromática
Unindo forças para a esperança e avanço da pesquisa
Nesta plataforma possibilitamos a interação entre o ciclo de pessoas afetadas pela LDM, contudo disponibilizando também a pesquisadores, laboratórios, profissionais da saúde que venham a necessitar das referências e informações apresentadas.
1. Missão, Visão e Valores
MISSÃO
Nossa missão é apoiar famílias, ampliar e disponibilizar o acesso à informação, identificar necessidades, auxiliar a promover cuidados que proporcionam uma qualidade de vida digna aos pacientes e familiares. Evidenciar junto a sociedade e autoridades a gravidade da doença e o amparo às famílias. Estimular e defender pesquisas para o tratamento da Leucodistrofia até que esta patologia metabólica seja definitivamente superada.
VISÃO
Ser referência nacional para informações técnico e científicas relativas ao diagnóstico e tratamentos, visando qualidade de vida dos pacientes.
Valores
Acolhimento através do diálogo, informação, humanização, influência e mobilização social.
2. O que é a Leucodistrofia Metacromática
A leucodistrofia (do grego: leuko = branca + dis = transtorno + troph = crescimento) é um grupo de desordens caracterizadas pela degeneração da substância branca do cérebro. As leucodistrofias têm como resultado final o desenvolvimento imperfeito ou a destruição da bainha de mielina, filme gorduroso que envolve os axônios e atua como isolamento elétrico, permitindo a condução dos sinais nervosos. Até o momento, há mais de 50 tipos de leucodistrofias, sendo a Leucodistrofia Metacromática um deles.A Leucodistrofia Metacromática (LDM) é uma doença genética rara de herança autossômica recessiva que afeta o depósito lisossômico, sendo contemporânea como um erro inato do metabolismo do grupo das doenças de depósito lisossômico. A LDM é caracterizada por degeneração progressiva do Sistema Nervoso, resultando em perda de capacidades motoras, intelectuais e cognitivas. A LDM é causada por mutações no gene que codifica a enzima arilsulfatase A (ARSA), que atua no metabolismo da mielina, e que, quando tem atividade deficiente, causa a manipulação de uma série de lipídeos sulfatados, os quais têm como função principal constitui a bainha de mielina das células do sistema nervoso central (SNC) e periférico (SNP).
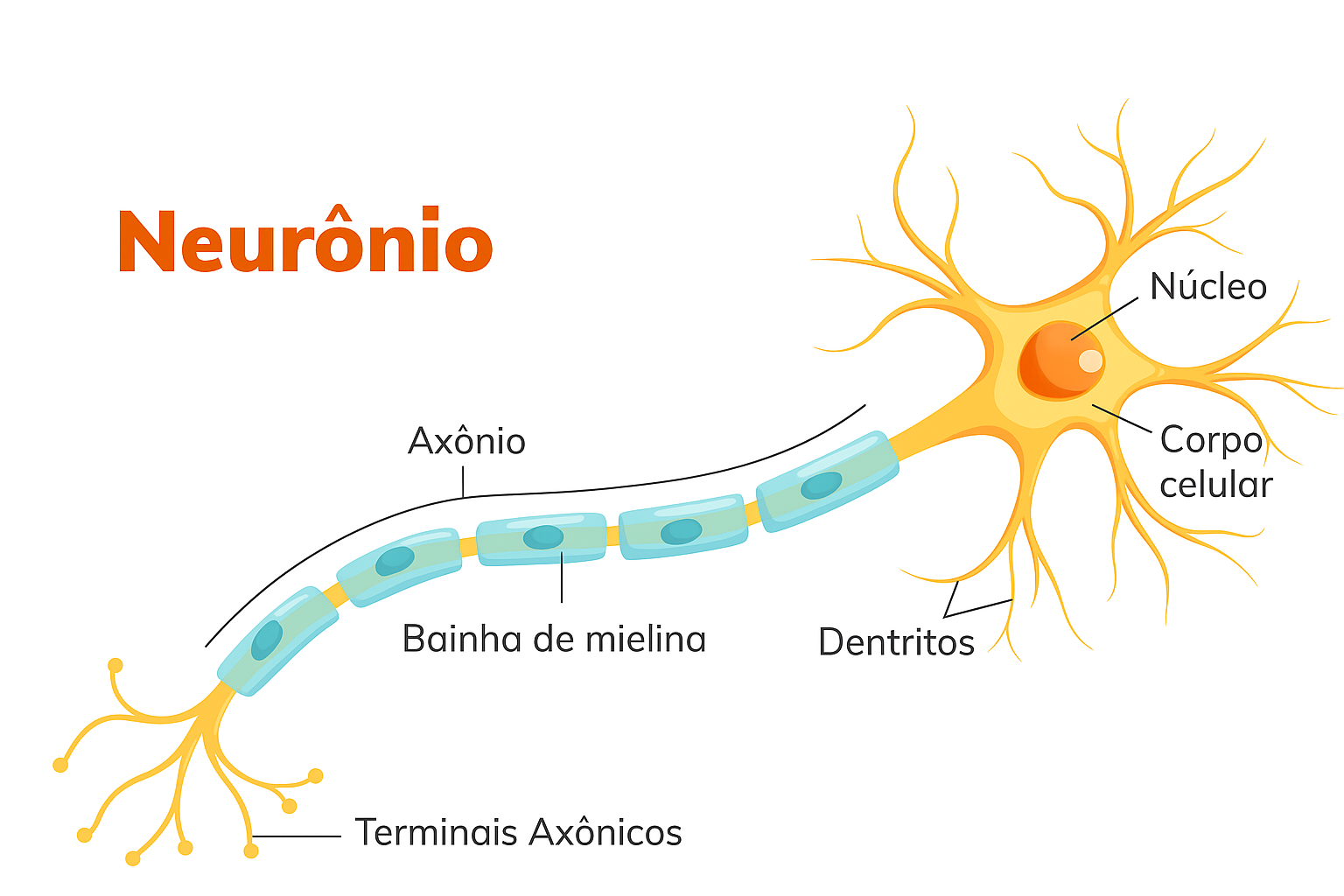
A LDM recebe esse nome pela forma como as células com acúmulo de sulfatídeos aparecem quando vistas em um microscópio. Os sulfatídeos formam grânulos que são descritos como “metacromáticos”, o que significa que eles captam a cor de forma diferente do material celular ao redor quando corados para exame.Com a deficiência de ARSA, os sulfatídeos se acumulam, eventualmente destruindo a bainha de mielina dos neurônios. A bainha de mielina é uma cobertura gordurosa que protege as fibras nervosas. Sem ela, os nervos no cérebro e os nervos periféricos deixam de funcionar corretamente.
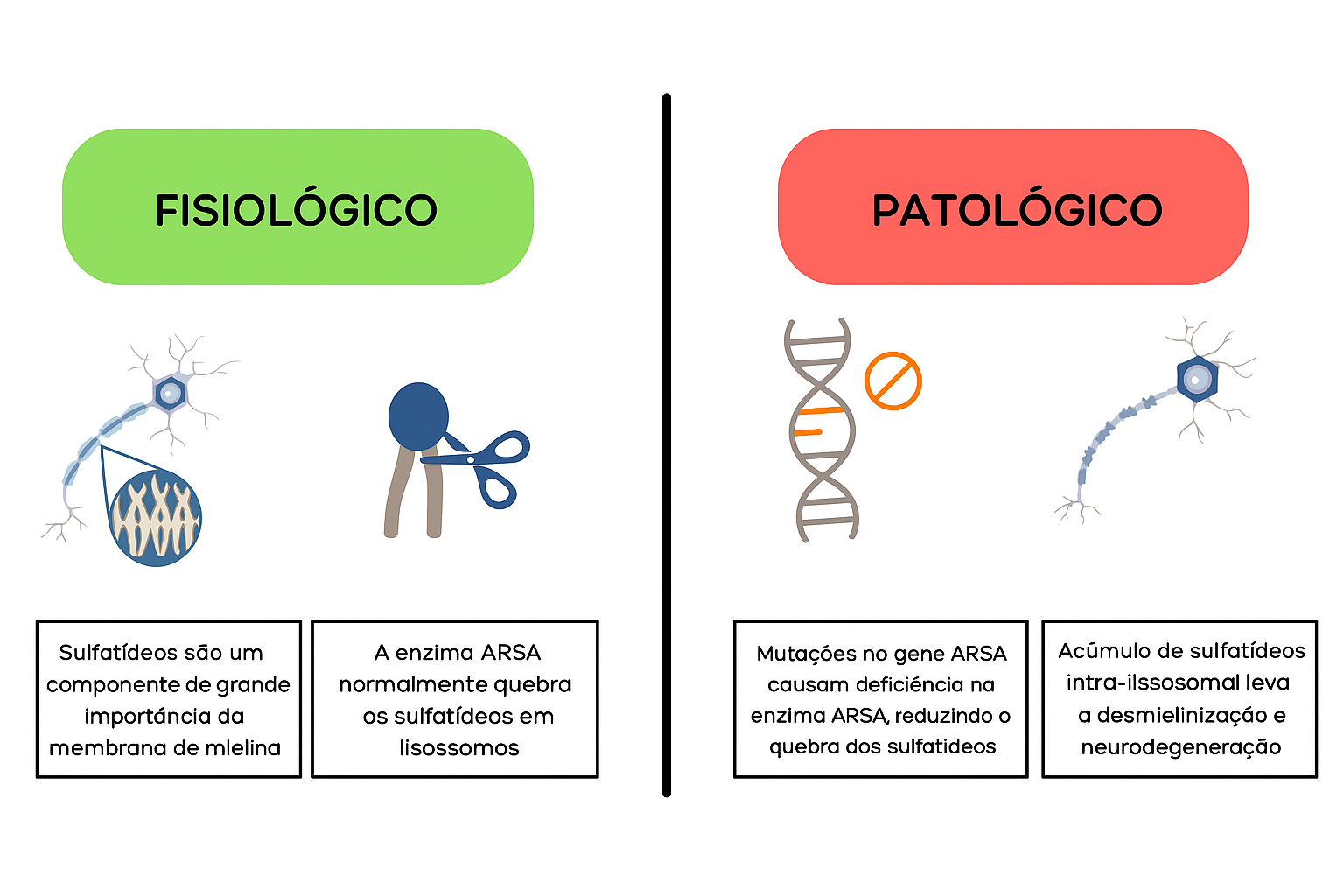
Figura 1. Adaptado de Cesani, M. et al (2016).
Isso leva ao acúmulo de sulfatídeos, que resultam na disfunção e destruição das bainhas de mielina do SNC/SNP. Também se acumula em outros órgãos, incluindo rins, testículos e vesícula biliar. A LDM pode ser classificada de três formas clínicas dependendo da gravidade e idade em que apareceram os primeiros sinais: forma infantil (ou infantil tardia), forma juvenil e adulta.
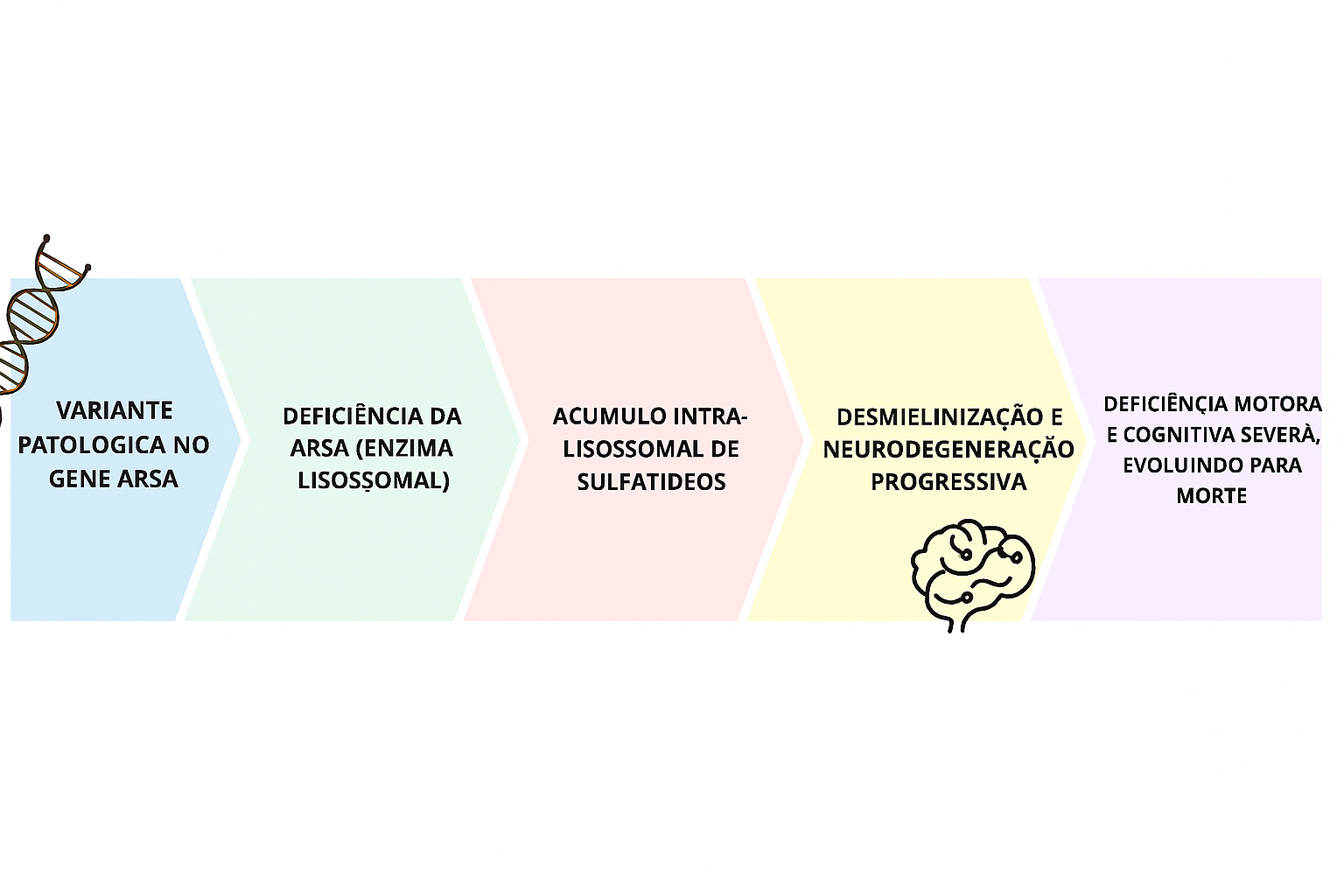
Figura 2. Progressão da Leucodistrofia Metacromática. Fonte: Gomez-Ospina N. Arylsulfatase A Deficiency. 2006 May 30 [Updated 2024 Apr 25]. In: Adam MP, Feldman J, Mirzaa GM, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2024. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1130/
A doença é categorizada com base na idade de início dos primeiros sintomas.
- Forma infantil tardia: até 30 meses de idade
- Forma juvenil: dos 30 meses (2,5 anos) até a puberdade
- Juvenil precoce: 2,5 anos a 6 anos
- Juvenil tardio: 6 a 16 anos
- Forma adulta: mais de 16 anos de idade.
Epidemiologia:A LDM é uma doença rara. Existem muitas formas de Leucodistrofia, mas a Leucodistrofia Metacromática (LDM) é uma das formas mais frequentes.A forma infantil tardia é a forma mais frequente de LDM, representando cerca de 50 a 60% dos casos.A prevalência da leucodistrofia metacromática varia de 1/40.000 a 1/100.000 nas populações do norte da Europa e da América do Norte.A condição é mais comum em certas populações geneticamente isoladas: 1 em 75 em um pequeno grupo de judeus que imigraram para Israel do sul da Arábia (habbanitas), 1 em 2.500 na porção ocidental da Nação Navajo e 1 em 8.000 entre grupos árabes em Israel.
Referências:
- Fonseca LF, Pianettil G, Xavier CC. Compêndio de neurologia infantil. São Paulo: Editora Medsi, 2001, 895p.
- Diament A, Cypel S. Neurologia infantil. 5a ed. São Paulo: Atheneu, 2010, 1887p
- Behrman RE, Kliegman RM. Princípios de pediatria. 4a ed. Rio de Janeiro: Guanabara Koogan, 2004, 1024p
- Fonseca LF, Xavier CC, Pianetti G. Compêndio de neurologia infantil. Rio de Janeiro: Editora Medsi, 2011, 953p
- CESANI, M. et al. Mutation update ofARSAandPSAPgenes causing metachromatic leukodystrophy. Human mutation, v. 37, n. 1, p. 16–27, 2016.
3. DIFERENTES APRESENTAÇÕES DA LEUCODISTROFIA METACROMÁTICA
Forma infantil tardia
é a forma mais frequente de LDM (50-60%), as crianças afetadas começam a ter dificuldade para andar após o primeiro ano de vida, geralmente entre 15 e 24 meses. O início ocorre antes dos 30 meses, com aparição dos sintomas normalmente próximos à fase em que a criança começa a caminhar. Normalmente, os marcos iniciais são atingidos, seguidos por uma regressão progressiva das habilidades motoras como ataxia, disartria, hipotonia, espasticidade, hipotonia, hiporreflexia, postura plantar extensora e atrofia óptica, que antecedem a deterioração mental. Esses sintomas são acompanhados de irritabilidade, quedas frequentes, sinal de Babinski, evoluindo para um quadro de espasticidade e graves limitações funcionais. Representa aproximadamente 50% dos casos, e a maioria dos pacientes morre até a primeira década de vida.
Início juvenil
A LDM juvenil tem início entre os 3 e 10 anos de idade, geralmente começando com a percepção de dificuldades no desempenho escolar. Início entre 30 meses e a puberdade, com uma apresentação heterogênea de parada do desenvolvimento intelectual. Inicia com dificuldades escolares, problemas emocionais e de comportamento e alterações na marcha. Percebe-se que os marcos iniciais são atingidos, seguidos por regressão psicomotora, declínio intelectual (por exemplo, queda no desempenho escolar), dificuldades comportamentais, alterações de personalidade, ataxia, sinais do neurônio motor superior e neuropatia periférica. No início juvenil tardio, o paciente se apresenta de forma semelhante, com convulsões +/-. Os testes neurocognitivos demonstram demência, perda de memória, desinibição, impulsividade, diminuição da função motora e atrofia óptica.
Início na idade adulta
A LDM de Início Adulto é a forma mais rara e geralmente começa após os 16 anos e, nos estágios iniciais, é frequentemente diagnosticada erroneamente como um transtorno psiquiátrico devido a mudanças comportamentais. O início dos sintomas costuma ser a partir dos 17 anos de idade onde o paciente mostra dificuldades neurocognitivas e neuropsiquiátricas de progressão lenta. Os sintomas mais associados estão relacionados com problemas comportamentais, emocionais e psíquicos. Os pacientes podem ter neuropatia periférica, psicose, esquizofrenia ou convulsões. É frequentemente diagnosticado erroneamente com transtorno bipolar e demência. Tende a ser exclusivamente neuropsiquiátrico com achados motores mínimos ou inexistentes. Os testes neurocognitivos neste grupo de pacientes se apresentam de forma semelhante ao grupo de início juvenil. Esses pacientes apresentam sobrevida de dez a vinte anos após o início dos sintomas.
4. SINTOMAS
Os sintomas da leucodistrofia metacromática variam de acordo com a idade de início e progressão da doença. Os sintomas da leucodistrofia metacromática podem variar com base na forma. Em geral, todas as formas levam a uma piora das funções neurológicas, incluindo movimento muscular, intelecto, humor, personalidade e mais. Leucodistrofias são geralmente suspeitas em pacientes pediátricos com dificuldades em atingir marcos de desenvolvimento apropriados quando antes era possível fazê-lo. A neuropatia periférica pode se apresentar antes da disartria e outras manifestações do SNC. Um declínio nas habilidades motoras grossas e finas em qualquer idade deve ser avaliado para leucodistrofia metacromática. A LDM é uma doença progressiva, o que significa que os sintomas pioram com o tempo.Em síntese, os sintomas da LDM infantil tardia podem incluir:
- Dificuldade para caminhar, especialmente para levantar os pés ou controlar os movimentos.
- Fala prejudicada.
- Dificuldade para engolir.
- Fraqueza e rigidez muscular.
- Escapes urinários.
- Regressão de habilidades já desenvolvidas.
- Atraso e regressão no desenvolvimento .
- Dificuldade para falar (disartria).
- Perda progressiva da visão.
- Dificuldade para engolir (disfagia).
Sintomas da LDM juvenil podem incluir:
- Declínio intelectual, que pode se manifestar como declínio no desempenho escolar.
- Alterações da fala.
- Problemas de comportamento.
- Problemas de equilíbrio, coordenação e caminhada.
- Mudanças de personalidade.
- Neuropatia periférica .
- Convulsões .
- Demência.
A LDM em adultos causa principalmente alterações psiquiátricas. Os primeiros sinais de LDM adulta podem ser transtorno por uso de álcool , transtorno por uso de substâncias e/ou dificuldades na escola ou no trabalho.
- Problemas psiquiátricos, como alucinações , psicose ou esquizofrenia .
- Convulsões.
- Neuropatia periférica.
- Demência.
Referências:"Metachromatic Leukodystrophy: Diagnosis, Modeling, and Treatment Approaches" publicado na Frontiers in Medicine.https://www.frontiersin.org/journals/medicine/articles/10.3389/fmed.2020.576221/fullMäkitie, O., & Sillanpää, N. (2021). Metachromatic leukodystrophy: Clinical features and diagnosis. Neurology, 96(7), e954-e961. doi:10.1212/WNL.00000000000004861Kelley, R. I., & Korman, S. H. (2020). Metachromatic leukodystrophy: A clinical and genetic overview. Genetics in Medicine, 22(2), 296-303. doi:10.1038/s41436-019-0568-3Jansen, L. A., & van der Knaap, M. S. (2019). Metachromatic leukodystrophy: Insights into clinical manifestations and disease mechanisms. Journal of Inherited Metabolic Disease, 42(2), 365-376. doi:10.1002/jimd.12029Bärtsch, T., & Rüschendorf, F. (2020). Clinical features of metachromatic leukodystrophy: A case study and review of the literature. European Journal of Pediatrics, 179(3), 509-516. doi:10.1007/s00431-019-03659-3
Tabela de sintomas e idades
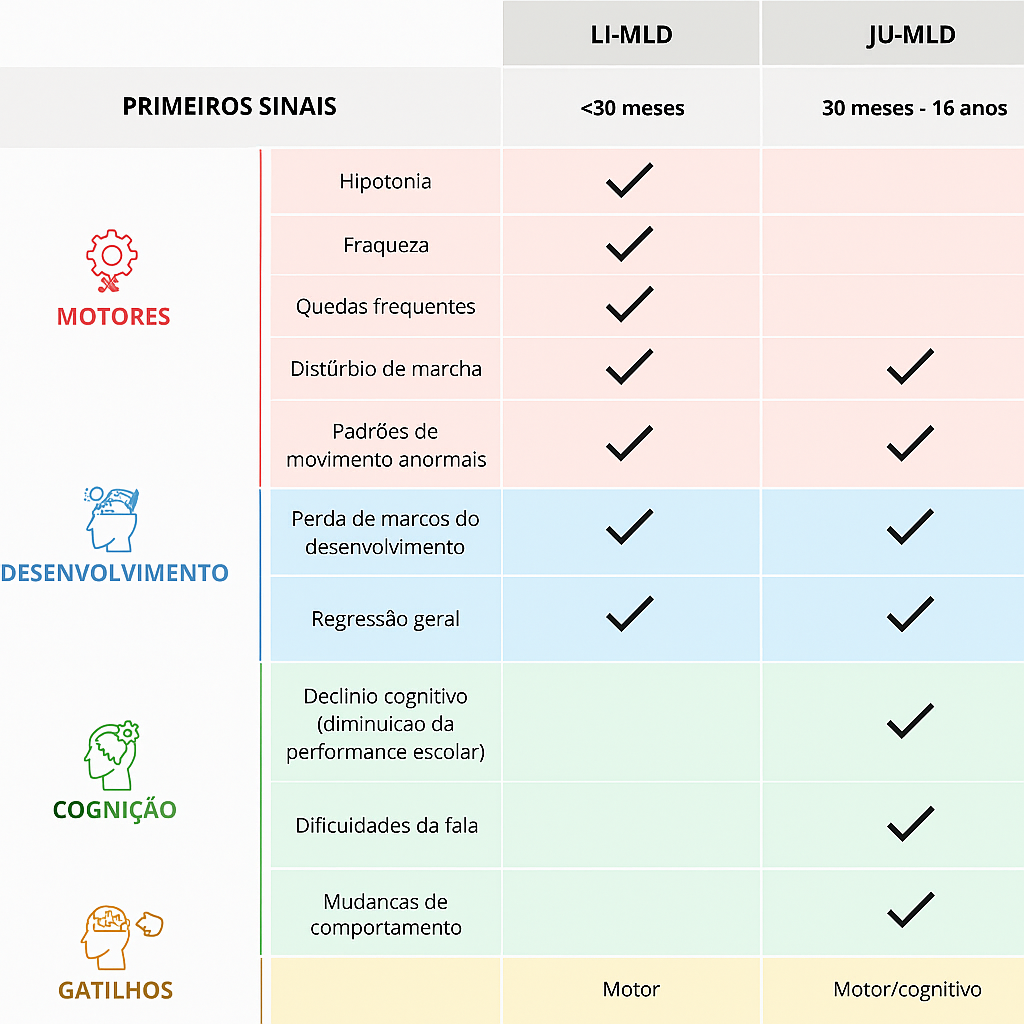
Figura 2: Apresentação clínica e sintomas de acordo com idades. Adaptado de from Von Figura K, et al., In: The metabolic and molecular bases of inherited disease, Vol. 3, 8th ed. New York: McGraw-Hill, 2001:3698-37247
- Alvarez-Pabón Y, Lozano-Jiménez JF, Di Lizio-Miele KG, Contreras-García GA. Leucodistrofia metacromática infantil tardía: Presentación de un caso [Late infantile metachromatic leukodystrophy: case report]. Arch Argent Pediatr. 2019 Feb 1;117(1):e52-e55. Spanish. doi: 10.5546/aap.2019.e52. PMID: 30652456.
- RIBEIRO, Erica de Queiroz; RIBEIRO, Maysa Ferreira Martins. Leucodistrofia Metacromática: Relato de Caso de Dois Irmãos Consanguíneos. Revista Neurociencias, [S. l.], p. 580 586, 1 ago. 2024. Disponível em: https://periodicos.unifesp.br/index.php/neurociencias/article/view/8152/5684. Acesso em: 31 jul. 2024.
5. DIAGNÓSTICO
Deve-se suspeitar de leucodistrofia metacromática em pacientes com declínio neurológico progressivo e alterações sugestivas da doença na ressonância magnética. O diagnóstico pode ser desafiador em muitos casos, como na forma infantil tardia, pois a ressonância magnética do cérebro pode ser inicialmente normal e os primeiros sintomas (hiporreflexia e atraso no desenvolvimento) são relativamente inespecíficos.
Para investigação, são realizados testes genéticos e bioquímicos, incluindo:- Atividade da enzima arilsulfatase A em glóbulos brancos (leucócitos do sangue) ou fibroblastos (células encontradas em tecido conjuntivo, em biópsia de pele);- Medição de sulfatídeos na urina;- Teste genético molecular para variantes patogênicas nos genes ARSA e PSAP;
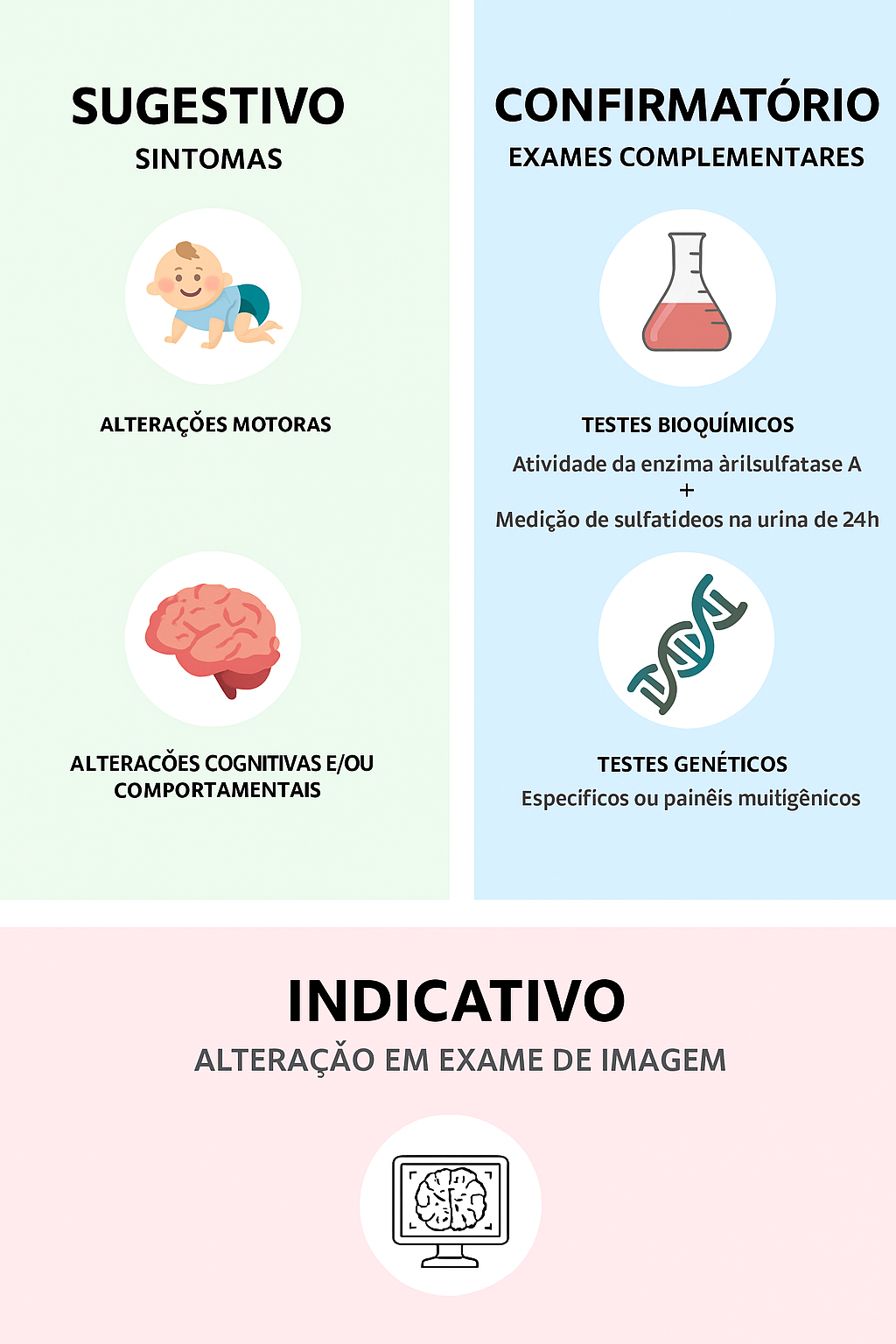
Figura 4. Critérios clínicos e laboratoriais para diagnóstico da leucodistrofia metacromática.
Tanto o ensaio enzimático quanto a medição de sulfatídeos urinários são partes essenciais do diagnóstico bioquímico, complementando o teste genético. Em um paciente com disfunção neurológica progressiva e/ou leucodistrofia, o diagnóstico é estabelecido quando observam-se alterações nos três exames.
A disponibilidade de triagem neonatal (teste do pezinho) para leucodistrofia metacromática é limitada e ainda não está disponível em todos os países.
Diagnósticos diferenciais:
- Doença de Krabbe: doença de depósito lisossomal de herança autossômica recessiva, causada pela atividade deficiente da enzima galactocerebrosidase. Clinicamente, apresenta-se com irritabilidade, hipertonia, hiperestesia e parada psicomotora.
- Adrenoleucodistrofia ligada ao X: Afeta principalmente meninos, é uma leucodistrofia que se apresenta com insuficiência adrenal, problemas neurocognitivos (baixo QI) e neurocomportamentais (comportamento semelhante ao TDAH), disartria, disgrafia, déficits na visão, audição.
- Doença de Canavan: É uma leucodistrofia de herança autossômica recessiva infantil caracterizada por deficiência intelectual, irritabilidade, macrocefalia, disfagia, hipotonia precoce, espasticidade tardia, ataxia, convulsões e atrofia óptica. Tem maior frequência na população judaica ashkenazi.
- Distúrbios da biogênese peroxissomal: Leucodistrofias causadas por mutações em um dos 13 genes PEX diferentes, que codificam as proteínas do peroxissomo, sendo PEX1 o mais comum, levando a peroxissomos disfuncionais. Os sintomas clínicos podem incluir deficiência intelectual, dismorfias craniofaciais, retinopatia (por exemplo, glaucoma, retinite pigmentosa), cegueira, surdez neurossensorial, hipotonia, hepatomegalia, coagulopatia, displasias renais, icterícia difusa, disfagia, condrodisplasia punctata e convulsões.
- Doença do corpo poliglucosano: Uma doença de herança autossômica recessiva de início adulto caracterizada por bexiga neurogênica progressiva, dificuldades de marcha (por exemplo, espasticidade e fraqueza) devido ao envolvimento misto dos neurônios motores superiores e inferiores, perda sensorial predominantemente nas extremidades inferiores distais e algumas dificuldades cognitivas (frequentemente disfunção executiva).
- Fucosidose: causada pela mutação FUCA1, caracterizada por fácies infiltrada, infecções oportunistas recorrentes, distonia generalizada, espasticidade, disostose múltipla, angioqueratoma difuso e visceromegalia..
- Esquizofrenia de início na infância: tem algumas características neurológicas e deve ser diferenciada da leucodistrofia metacromática. A esquizofrenia se apresenta com delírios, alucinações, fala desorganizada e comportamento grosseiramente desorganizado ou catatônico.
- Pseudodeficiência: Em alguns casos, indivíduos com atividade de arilsulfatase A muito baixa não desenvolvem sintomas de leucodistrofia metacromática. Essa condição é chamada de pseudo deficiência de arilsulfatase. Por este motivo é fundamental a realização da dosagem dos sulfatídeos na urina na etapa de investigação diagnóstica.
6. Tratamento da Leucodistrofia Metacromática
Não há cura disponível atualmente para a LDM, o foco está na melhoria da qualidade de vida, tratando os sintomas.
Tratamento sintomático:
- Convulsões: Medicamentos antiepiléticos ou anticonvulsivantes
- Espasticidade: baclofeno, ciclobenzaprina, toxina botox A
- Distonia: toxina botulínica, medicamentos sintomáticos
- Disautonomia: terapia anticolinérgica, midodrina oral ou fludrocortisona
- Dor: AINEs, gabapentina, pregabalina, inibidores de recaptação de serotonina-norepinefrina, etc.
- Problemas nutricionais e gastrointestinais: famotidina ou pantoprazol para pirose e refluxo; Docusato e sena para facilitar a evacuação, ajudando no alívio da constipação; Gastrostomia e sondas para ajudar com problemas de alimentação e nutrição.
- Problemas de insônia/humor - IRSNs, como mirtazapina, antidepressivos tricíclicos (TCAs), inibidores de recaptação de serotonina (ISRS), etc.
- Artralgias/mialgias, mobilidade, deficiências funcionais nas atividades da vida diária - terapia física, ocupacional, cognitiva e de marcha
Terapias multiprofissionais:O tratamento da leucodistrofia metacromática envolve uma abordagem multiprofissional que reúne diversas especialidades para atender às necessidades físicas, mentais e sociais dos pacientes. Esse cuidado integrado é essencial para melhorar a qualidade de vida e retardar a progressão dos sintomas.
- Fisioterapia (FST): Ajuda a melhorar a mobilidade, a força muscular e a flexibilidade, aliviando a dor e a rigidez dos músculos. É importante para manter a capacidade de movimentação e prevenir complicações.
- Fonoaudiologia: Foca em dificuldades de comunicação e deglutição. Técnicas específicas ajudam o paciente a se expressar e a se alimentar com mais segurança, evitando riscos como engasgos e desnutrição.
- Terapia Ocupacional: Trabalha com o desenvolvimento de habilidades para atividades diárias, como higiene pessoal, alimentação e vestimenta. Isso ajuda a preservar a autonomia do paciente e facilita o dia a dia.
- Psicoterapia: Suporte essencial para enfrentar os desafios emocionais e de saúde mental associados à LM, ajudando o paciente e sua família a lidar com o diagnóstico e o tratamento.
- Entre outros.
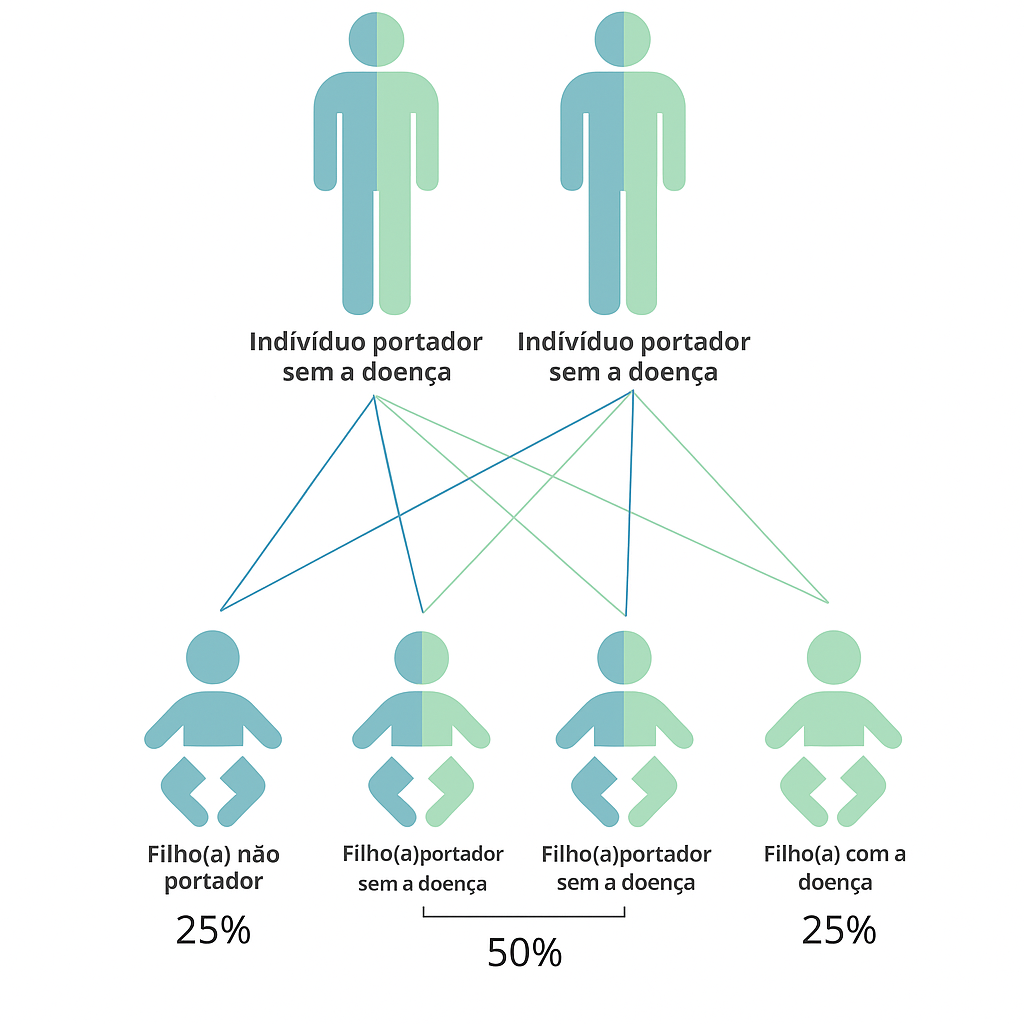
Aconselhamento genético:Essa condição é herdada em um padrão autossômico recessivo , o que significa que ambas as cópias do gene em cada célula têm mutações. Os pais de um indivíduo com uma condição autossômica recessiva carregam cada um uma cópia do gene mutado, mas eles normalmente não mostram sinais e sintomas da condição.A LDM é herdada de forma autossômica recessiva. Na concepção, cada irmão/ã de um indivíduo afetado tem 25% de chance de ser afetado, 50% de chance de ser um portador assintomático e 25% de chance de não ser afetado e não ser um portador. Este risco é válido para cada gestação do casal que já teve um filho ou filha com LDM.O aconselhamento genético na leucodistrofia metacromática (LM) desempenha um papel essencial para famílias que enfrentam essa condição. Esta doença é transmitida de forma autossômica recessiva, o que significa que tanto meninos quanto meninas têm o mesmo risco de nascerem com LM. Para que uma pessoaseja afetada, é necessário que ambos os pais transmitam uma cópia alterada do gene específico. Caso um dos genes seja normal, a pessoa será apenas portadora e não manifestará sintomas, mas pode transmitir a variante aos seus filhos.
O aconselhamento genético não se resume apenas a explicar como a LDM é herdada ou a discutir o risco de recorrência. Ele envolve uma orientação abrangente para entender o diagnóstico, o acompanhamento, as opções de tratamento e o impacto emocional e familiar da condição. Profissionais especializados em genética médica oferecem apoio à família na tomada de decisões e no planejamento dos cuidados necessários.Quando há um diagnóstico genético prévio de LDM na família, é possível discutir alternativas reprodutivas, como a seleção de embriões saudáveis em casos de fertilização in vitro (FIV), utilizando testes genéticos específicos. Essa opção é uma das formas de prevenir a transmissão da doença e deve ser realizada dentro de um processo de aconselhamento genético, garantindo que a família esteja informada e preparada para tomas de forma autônoma e orientada as decisões necessárias em cada passo.
A) TRATAMENTOS APROVADOS
Atualmente, os tratamentos aprovados para MLD são limitados e principalmente relacionados ao manejo dos sintomas (Biffi et al. 2013). O transplante de células-tronco hematopoéticas (TCTH) é atualmente o tratamento mais amplamente aceito para a leucodistrofia metacromática. Esse procedimento substitui células-tronco doentes por células-tronco saudáveis de um doador compatível, podendo retardar ou interromper a progressão da doença, especialmente em pacientes que ainda não apresentaram sintomas graves (Biffi et al., 2013).O transplante de células hematopoiéticas pode ser benéfico em formas juvenis ou adultas de leucodistrofia metacromática quando realizado em estágio inicial. O transplante de células-tronco hematopoiéticas pode estabilizar a progressão da doença quando realizado em um estágio inicial e pré-sintomático (ou seja, antes do início dos sintomas). A avaliação da indicação é individual e deve ser discutida conjuntamente pela equipe médica assistente e em conjunto com a família (https://onlinelibrary.wiley.com/doi/full/10.1002/acn3.50975 e https://jamanetwork.com/journals/jamaneurology/fullarticle/2532819).
Outros tratamentos estão em desenvolvimento ou ainda não foram aprovados no território nacional e estão detalhados na seção “tratamentos em desenvolvimento”.
B) TRATAMENTOS EM DESENVOLVIMENTO
Link tabela para inclusão no site: Leucodistrofia metacromática - tabela de ensaios clínicos
1) Terapia de Reposição Enzimática - Arilsulfatase A intravenosa: https://pubmed.ncbi.nlm.nih.gov/33332761/
A leucodistrofia metacromática é uma doença de armazenamento lisossomal, causada pela atividade deficiente da arilsulfatase A. A terapia de substituição enzimática busca compensar a deficiência enzimática presente na MLD administrando a enzima funcional exogenamente para compensar a deficiência enzimática característica da MLD.Evidência científica: Ensaios clínicos e estudos pré-clínicos mostraram que a arilsulfatase A (ASA) humano recombinante intravenoso (IV) - rhASA - pode aumentar os níveis de enzima funcional no corpo, mas a sua capacidade de atravessar a barreira hematoencefálica é limitada, restringindo a eficácia no sistema nervoso central.Desfechos preliminares: Potencialmente benéfica nos estágios iniciais da doença; eficácia limitada em fases avançadas devido à dificuldade de entrega da enzima ao cérebro.Estágio de desenvolvimento: Ainda em fases de pesquisa e desenvolvimento, com estudos clínicos em andamento.
2) Terapias de Modulação do Metabolismo - Administração de Varfarina
Beerepoot, S., Nierkens, S., Boelens, J.J. et al. Neuropatia periférica na leucodistrofia metacromática: status atual e perspectiva futura. Orphanet J Rare Dis 14, 240 (2019). https://doi.org/10.1186/s13023-019-1220-4As terapias de modulação do metabolismo são uma abordagem promissora no tratamento da leucodistrofia metacromática (MLD). Essas terapias visam ajustar o metabolismo celular para compensar a deficiência enzimática causada pela mutação genética que leva à MLD. Uma das terapias alternativas estudadas sobre o metabolismo é a administração de varfarina. A hipótese é que a disponibilidade de vitamina K poderia ser um passo limitante na produção de esfingolipídios e na conversão de cerefásidos em sulfatídeos. Como a varfarina é um antagonista da vitamina K, foi levantada a possibilidade de que ela poderia mitigar o fenótipo da LDM, reduzindo a formação de sulfatídeos.Evidência científica: Pesquisas pré-clínicas indicam que essas abordagens podem reduzir a acumulação de substâncias tóxicas nas células afetadas, incluem a redução do acúmulo de substrato, mas ainda estão em fases iniciais de estudo.Desfechos preliminares: Eficaz em modelos animais e estudos iniciais, necessitando de mais pesquisa para validação clínica em humanos. Estágio de desenvolvimento: Os estudos com varfarina estão em estágios iniciais de pesquisa clínica. Embora os resultados pré-clínicos sejam promissores, são necessários mais ensaios clínicos com maior número de participantes para validar a eficácia e segurança dessa abordagem em pacientes com LDM.
3) Terapia genética com células-tronco hematopoiéticas autólogas: https://clinicaltrials.gov/study/NCT02559830?cond=Metachromatic%20Leukodystrophy&aggFilters=status:not%20rec%20act%20com%20ter%20enr%20sus&viewType=Table&limit=100&page=1&rank=7A terapia genética com células-tronco hematopoiéticas autólogas (HSC) para tratamento da Leucodistrofia Metacromática (LM) é uma abordagem que está sendo estudada, visando tratar a doença utilizando as próprias células-tronco do paciente. As células são coletadas, geneticamente modificadas em laboratório, a fim de expressar a enzima arilsulfatase A (ASA) e, em seguida, reinfundidas no paciente. A modificação genética corrige a deficiência enzimática, permitindo que as células produzam ASA, ajudando a prevenir o acúmulo de sulfatídeos e a progressão da doença.Evidência Científica: O estudo clínico investiga o uso de células-tronco hematopoiéticas autólogas modificadas geneticamente para tratar a Leucodistrofia Metacromática (LM), focando na expressão da enzima arilsulfatase A (ASA).Desfechos preliminares: Os resultados preliminares sugerem que a terapia pode prevenir a progressão da doença, possivelmente mais eficaz em pacientes pré-sintomáticos ou nos estágios iniciais, quando ainda há pouca ou nenhuma degradação neurológica irreversível; mas dados concretos sobre a eficácia geral ainda estão sendo coletados e analisados.Estágio de desenvolvimento: O estudo encontra-se em fase 1/2, indicando que está testando segurança, dosagem e eficácia preliminar em um pequeno grupo de pacientes.
4) Modelagem do padrão de ativação de macrófagos na adrenoleucodistrofia ligada ao cromossomo X: https://clinicaltrials.gov/study/NCT04925349?cond=Metachromatic%20Leukodystrophy&aggFilters=status:not%20rec%20act%20com%20ter%20enr%20sus&viewType=Table&limit=100&page=1&rank=17Embora a Leucodistrofia Metacromática (LM) não seja considerada uma doença neuroinflamatória, observa-se uma ativação dos macrófagos do Sistema Nervoso Central (SNC), juntamente ao aumento de citocinas inflamatórias no cérebro de pacientes com DLM e em camundongos. Sendo assim, estudos recentes buscam entender como os macrófagos são ativados e funcionam, podendo revelar alvos terapêuticos e estratégias que podem ser aplicadas para tratar outras doenças de desmielinização, como a leucodistrofia metacromática.Evidência Científica: O estudo visa entender o padrão de ativação dos macrófagos no SNC em pacientes com adrenoleucodistrofia ligada ao X, observando o aumento de citocinas inflamatórias.Desfechos preliminares: Este estudo é exploratório e focado em identificar alvos terapêuticos potenciais, portanto, não há dados concretos de eficácia para tratamentos específicos.Estágio de desenvolvimento: O estudo está em fase de pesquisa básica e observacional, concentrando-se na modelagem e compreensão da ativação dos macrófagos.
5) Transplante de SCU de Doenças Metabólicas Hereditárias com Administração de Células Oligodendrócitos-Semelhantes Derivadas de SCU Intratecais: https://clinicaltrials.gov/study/NCT02254863?cond=Metachromatic%20Leukodystrophy&aggFilters=status:not%20rec%20act%20com%20ter%20enr%20sus&viewType=Table&limit=100&page=1&rank=21
O transplante de células-tronco hematopoiéticas do cordão umbilical (SCU) com administração intratecal de células oligodendrócitos-semelhantes derivadas de SCU, é uma abordagem inovadora para tratar doenças metabólicas hereditárias como a leucodistrofia metacromática (LM). O processo envolve a coleta e preparação das células-tronco do cordão umbilical, seguidas de sua diferenciação em células oligodendrócitos-semelhantes, responsáveis pela produção de mielina no sistema nervoso central. Essas células, por fim, são administradas diretamente no líquido cefalorraquidiano por meio de uma injeção intratecal, permitindo que alcancem o sistema nervoso central de maneira mais eficaz. Possíveis benefícios:
- Remielinização: ajuda a reparar a mielina danificada, melhorando a condução nervosa e a função neurológica.
- Efeitos imunomoduladores: ajudando a reduzir a inflamação no sistema nervoso central, o que pode levar a uma melhora nos sintomas motores e cognitivos, resultando em uma melhor qualidade de vida para os pacientes.
Evidência Científica: Este estudo avalia a eficácia do transplante de células-tronco hematopoiéticas do cordão umbilical (SCU) com administração intratecal de células oligodendrócitos-semelhantes derivadas de SCU para tratar doenças metabólicas hereditárias como a Leucodistrofia Metacromática (LM).Desfechos preliminares: Os resultados preliminares indicam que essa abordagem pode melhorar a condução nervosa e função neurológica, bem como reduzir a inflamação no sistema nervoso central.Estágio de desenvolvimento: O estudo está em fase inicial, focando na segurança e eficácia preliminar.
C) PESQUISA CLÍNICA NO BRASIL
https://pubmed.ncbi.nlm.nih.gov/?term=Metachromatic+Leukodystrophy&filter=pubt.clinicaltrial – ensaios clínicos sobre a Leucodistrofia Metacromática
No Brasil, a pesquisa clínica sobre a Leucodistrofia Metacromática (DLM) está em fase de ascensão. Atualmente contamos com um estudo intervencional, não-randomizado, multicêntrico aberto, que avalia os resultados de segurança e eficácia do HGT-1110 administrado por via intratecal em crianças com DLM que participaram do estudo de escalonamento de dose, HGT-MLD-070 (NCT01510028), até a Semana 40 e estão recebendo o medicamento do estudo a cada duas semanas. O Hospital de Clínicas de Porto Alegre é o representante brasileiro dentro da pesquisa, que conta também com outros 14 centros. Dentre eles podemos citar “The Children's Hospital at Westmead” em Westmead, Austrália; “Detska Interni Klinika” em Brno na Tcheca e “Rigshospitalet” em Copenhagen na Dinamarca.
O estudo está ativo, porém já passou da fase de recrutamento, e opera com 24 participantes entre 0 e 13 anos de idade, de todos os sexos, cujos critérios de inclusão foram definidos pela participação do Estudo HGT-MLD-070 (NCT01510028) até a Semana 40, ausência de problemas médicos ou de segurança que contra indiquem a participação, e o fornecimento de consentimento por parte do participante, os pais do participante ou representantes legais autorizados, informado por escrito e/ou assentimento (se aplicável) antes de realizar quaisquer atividades relacionadas ao estudo
A primeira publicação ocorreu em 2013-06-27 e a última atualização em 2023-07-21
D) TRATAMENTOS PARA QUALIDADE DE VIDA - Fisioterapia, fonoaudiologia, Terapia ocupacional, equoterapia, hidroterapia, possibilidade de gastro (dependendo dos avanços dos sintomas), alimentação - Acompanhamentos multidisciplinares sugeridos.
A progressão clínica da LDM cursa com alterações cognitivas e neuromotoras que, inicialmente, limitarão o indivíduo a exercer certas funções diárias e que, a longo prazo, poderá evoluir a ponto de torná-lo completamente dependente de assistência externa. Algumas dessas alterações são: perda gradativa de sustentação postural, dificuldade de fala, crises convulsivas, ataxia, hipertonia muscular crescente, deformidades osteomusculares.
Nesse contexto, o acompanhamento multidisciplinar é de suma importância para melhorarmos a qualidade de vida e sintomatologia do paciente. O foco principal da equipe de reabilitação é a prevenção de complicações secundárias, como as deformidades osteomusculares, as infecções e aspirações brônquicas que podem evoluir para quadros graves de pneumonia. Os profissionais que estão mais envolvidos na reabilitação funcional são os fisioterapeutas, fonoaudiólogos e psicólogos. Eles utilizam diversas técnicas e ferramentas que retardam o avanço da doença e melhoram a qualidade de vida dos pacientes. As intervenções fisioterapêuticas, por exemplo, auxiliam no mantimento da postura adequada, evitando e/ou atrasando o surgimento das deformidades.
RIBEIRO, Erica de Queiroz; RIBEIRO, Maysa Ferreira Martins. Leucodistrofia Metacromática: Relato de Caso de Dois Irmãos Consanguíneos. Revista Neurociências, [S. l.], v. 21, n. 4, p. 580–586, 2013. DOI: 10.34024/rnc.2013.v21.8152. Disponível em: https://periodicos.unifesp.br/index.php/neurociencias/article/view/8152. Acesso em: 17 jul. 2024.
Guimarães, E. L., & Toledo, D. K. B. LEUCODISTROFIA METACROMÁTICA (LDM)–ESTUDO DE CASO. http://www.unifafibe.com.br/revistasonline/arquivos/revistafafibeonline/sumario/9/18052011154032.pdf O objetivo central do manejo clínico deve ser focado na melhoria da qualidade de vida por meio de medidas gerais. Todas as medidas devem ser utilizadas com vistas a maximizar as funções intelectuais e neuromusculares, através da otimização do aporte nutricional (inclusive com a decisão ou não do uso de gastrostomia), terapia física (terapia motora e respiratória), manejo de complicações infecciosas e controle farmacológico das crises convulsivas (Balsev et al., 1997). É sempre importante que o tratamento desses pacientes ocorra dentro de uma equipe multidisciplinar, sendo oferecida uma rede de suporte à família, já que mesmo os casos mais graves da forma infantil tardia podem ter uma evolução arrastada por mais de uma década.https://lume.ufrgs.br/bitstream/handle/10183/29560/000703450.pdf?sequence=1&isAllowed=y
7. NOTÍCIAS
https://www1.folha.uol.com.br/equilibrioesaude/2024/03/terapia-para-doenca-genetica-rara-se-torna-o-medicamento-mais-caro-do-mundo-a-us-425-milhoes.shtml
A matéria aborda a aprovação do Lenmeldy (nome comercial nos EUA), uma nova terapia genética desenvolvida pela Orchard Therapeutics para tratar a leucodistrofia metacromática, uma doença genética rara e fatal que afeta o sistema nervoso central de crianças pequenas. Este medicamento mostrou resultados promissores em estudos clínicos, melhorando significativamente a sobrevida e a qualidade de vida dos pacientes. A aprovação oferece uma nova esperança para as famílias, apesar dos desafios econômicos e emocionais impostos pela doença.
https://www.correiodopovo.com.br/notícias/saúde/pais-de-crianças-com-doenças-raras-lutam-contra-suspensão-de-estudo-experimental-no-rs-1.1470867
Pais de crianças com leucodistrofia metacromática no Rio Grande do Sul estão lutando contra a suspensão de um estudo experimental que fornece tratamento vital para seus filhos. Pelo menos sete crianças, que recebem um medicamento experimental no Hospital de Clínicas de Porto Alegre, podem ter seus tratamentos interrompidos após o laboratório responsável anunciar que a última infusão será em 30 de abril. Apesar do laboratório afirmar que o medicamento não atingiu os objetivos esperados, os pais e médicos relatam melhorias significativas na qualidade de vida das crianças. A Comissão Nacional de Ética em Pesquisa (Conep) está envolvida, instruindo o laboratório a continuar fornecendo a medicação de acordo com os direitos dos participantes de pesquisa com doenças raras.
https://revistacrescer.globo.com/criancas/saude/noticia/2023/02/menina-de-1-ano-e-primeira-britanica-a-receber-cura-genetica-de-doenca-rara.ghtml
Teddi, uma menina de 1 ano e 7 meses com leucodistrofia metacromática (LDM), se tornou a primeira paciente no Reino Unido a receber uma cura genética revolucionária oferecida pelo sistema público de saúde, o NHS. Este tratamento, chamado Libmeldy (nome comercial na Europa) e desenvolvido pela Orchard Therapeutics, é o mais caro já fornecido pelo NHS. A terapia envolve a substituição de genes defeituosos nas células-tronco do paciente. Apesar do sucesso no caso de Teddi, sua irmã mais velha, Nala, não pôde se beneficiar devido ao estágio avançado da doença. A família Shaw espera que a triagem neonatal para LDM seja implementada para evitar que outras famílias passem por essa dor.
https://www12.senado.leg.br/radio/1/noticia/2024/02/28/dia-mundial-das-doencas-raras-e-lembrado-em-debate-no-senado
No dia 28 de fevereiro, a Comissão de Assuntos Sociais do Senado realizou uma audiência pública em homenagem aos 10 anos da Portaria nº 199/2014, que criou a Política Nacional de Atenção Integral às Pessoas com Doenças Raras. O debate destacou a importância de discutir as condições e desafios enfrentados por essas pessoas no Brasil, sendo presidido pela senadora Damares Alves (Republicanos-DF).
A senadora Damares Alves enfatizou o papel crucial da sociedade civil na promoção e defesa dos direitos das pessoas com doenças raras. Mauri dos Santos, pai de um jovem com leucodistrofia metacromática, compartilhou os desafios diários enfrentados pelas famílias desde o diagnóstico até o manejo da doença.João Batista Silva, representante da Anvisa, ressaltou as dificuldades no desenvolvimento e aprovação de medicamentos para doenças raras, devido ao pequeno número de pacientes para ensaios clínicos. Ele destacou a necessidade de a agência ser ágil na aprovação desses produtos.
https://www.forbes.com/sites/williamhaseltine/2024/05/07/from-research-to-reality-gene-therapy-for-metachromatic-leukodystrophy/
William A. Haseltine discute os avanços na terapia gênica para leucodistrofia metacromática (MLD), uma doença neurodegenerativa rara. Um novo vetor de vírus adeno-associado, AAVPHP.eB, mostrou-se promissor em camundongos ao corrigir anomalias de armazenamento de sulfátides e alcançar eficientemente o cérebro e a medula espinhal.
O estudo representa um passo importante para tornar a terapia gênica uma realidade clínica para MLD, com potencial para tratar outras doenças neurodegenerativas e de armazenamento lisossômico. A abordagem de injeção direta pode simplificar e tornar as terapias gênicas mais acessíveis, eliminando a necessidade de procedimentos complexos de modificação celular.
https://www.ajmc.com/view/fda-approves-arsa-cel-for-metachromatic-leukodystrophy
A FDA aprovou a terapia gênica Lenmeldy, da Orchard Therapeutics, para tratar leucodistrofia metacromática (MLD) em pacientes pediátricos pré sintomáticos ou com sintomas iniciais. Esta é a primeira terapia gênica aprovada para essa doença rara, caracterizada por declínios progressivos nos sistemas nervosos central e periférico devido à mutação no gene ARSA, que resulta na destruição da mielina nos nervos. O tratamento envolve uma infusão única de células-tronco hematopoéticas geneticamente modificadas do próprio paciente após um regime de quimioterapia.
Estudos mostraram que a terapia reduz significativamente o risco de morte e deficiência motora grave em comparação com pacientes não tratados. Entre os efeitos colaterais mais comuns estão neutropenia febril, baixa contagem de glóbulos brancos, infecções respiratórias e risco potencial de câncer hematológico, necessitando de monitoramento vitalício.
https://medicalxpress.com/news/2024-04-gene-therapy-metachromatic-leukodystrophy-effective.html
A leucodistrofia metacromática é um distúrbio genético raro que afeta principalmente crianças e resulta em sintomas neurológicos graves, perda de capacidades motoras e intelectuais. No Instituto do Cérebro de Paris, Françoise Piguet e sua equipe desenvolveram uma terapia gênica capaz de corrigir a principal anomalia da doença: o acúmulo de sulfatídeos no cérebro e na medula espinhal. Essa terapia, eficaz em camundongos conforme publicado na revista Molecular Therapy—Methods & Clinical Development, abre caminho para ensaios clínicos. Utilizando um tipo específico de vírus adeno-associado (AAVPHP.eB) que pode atravessar a barreira hematoencefálica, os pesquisadores conseguiram introduzir uma cópia funcional do gene ARSA nos cérebros dos camundongos deficientes nesse gene.
Os resultados foram promissores: o gene saudável se espalhou com sucesso para os neurônios-alvo, que começaram a secretar a enzima arilsulfatase A, corrigindo a atividade das células próximas. Os níveis de sulfatídeos retornaram ao normal e a neuroinflamação foi significativamente reduzida, mesmo em camundongos com a doença em estágio avançado. Esses dados robustos permitem agora a avaliação do tratamento em primatas, com vistas à organização de ensaios clínicos em humanos.
https://www.rte.ie/radio/radio1/highlights/1458494-campaigning-for-mld-screening-at-birth-on-liveline/
Carol compartilhou no programa Liveline sobre sua sobrinha Maebhe, uma criança de dois anos diagnosticada com leucodistrofia metacromática (MLD). Inicialmente, Maebhe parecia saudável, mas aos 18 meses não estava falando ou andando como esperado. Eventualmente, ela foi diagnosticada com MLD, uma condição genética terminal que afeta gravemente o desenvolvimento motor e intelectual. Em menos de oito meses após o diagnóstico, Maebhe ficou paralisada do pescoço para baixo e agora depende de medicamentos pesados. Carol descreveu o impacto devastador da doença sobre Maebhe e sua família, especialmente sua irmã de quatro anos, Tina.
Carol defende a inclusão de testes para MLD no teste do pezinho, feito em todos os recém-nascidos na Irlanda. Atualmente, apenas irmãos mais novos de crianças diagnosticadas são testados, o que significa que uma criança precisa morrer para que a outra receba tratamento precoce. Carol acredita que a implementação imediata do teste para MLD pode salvar vidas e evitar o sofrimento de muitas famílias. A HSE está considerando essa inclusão, mas Carol insiste que isso deve ser feito urgentemente para prevenir mais mortes desnecessárias.
8. ARTIGOS
https://periodicos.unifesp.br/index.php/neurociencias/article/view/8152/5684
https://www.scielo.br/j/anp/a/mzLxhbWq9pQqgn4jRJCTkqN/?lang=pt (Marina e Rafa)
https://rarediseases.info.nih.gov/diseases/3230/index
https://rarediseases.org/rare-diseases/metachromatic-leukodystrophy/
https://www.ncbi.nlm.nih.gov/books/NBK560744/
https://www.mldsupportuk.org.uk/about-mld/
https://www.huntershope.org/family-care/leukodystrophies/metachromatic-leukodystrophy/
https://www.chp.edu/our-services/rare-disease-therapy/conditions-we-treat/metachromatic-leukodystrophy
https://my.clevelandclinic.org/health/diseases/6067-metachromatic-leukodystrophy
https://www.gosh.nhs.uk/conditions-and-treatments/conditions-we-treat/metachromatic-leukodystrophy-late-infantile-form/
https://www.mayoclinic.org/diseases-conditions/metachromatic-leukodystrophy/symptoms-causes/syc-20354733
https://medlineplus.gov/genetics/condition/metachromatic-leukodystrophy/
https://omim.org/entry/249900
https://omim.org/entry/250100
Gomez-Ospina N. Arylsulfatase A Deficiency. 2006 May 30 [Updated 2024 Apr 25]. In: Adam MP, Feldman J, Mirzaa GM, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2024. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1130/
9. Instituições de APOIO
https://www.casahunter.org.br
Casa Hunter: Associação que oferece suporte a pacientes com doenças raras e seus familiares, com foco na promoção de políticas públicas e conscientização.
https://cdr.org.br/
Casa dos raros - apoio em diagnósticos, tratamentos e desenvolvimento de projetos e pesquisas em doenças raras, treinamento e capacitação profissional.
https://clinicaltrials.gov/
Site para acompanhamento de pesquisas em desenvolvimento.
https://mldfoundation.org
The MLD Foundation: Organização internacional dedicada ao apoio a pacientes com Leucodistrofia Metacromática, com recursos para famílias e profissionais de saúde.
https://theglia.orgThe Global Leukodystrophy Initiative (GLIA): Aliança internacional de organizações dedicadas à pesquisa e apoio a pacientes com leucodistrofias.
https://ela-asso.com/en/
The European Leukodystrophy Association (ELA): Associação europeia que apoia a pesquisa e as famílias afetadas por leucodistrofias, incluindo MLD.
https://ulf.org
The United Leukodystrophy Foundation (ULF): Organização americana que fornece suporte para famílias e promove pesquisa sobre leucodistrofia
Instituto de apoio ao participante de pesquisa Juliana Barbosa
Contato
- Canoas, RS, Brasil
 +55-35999649977 - Associação Leucodistrofia Metacromática Brasil
+55-35999649977 - Associação Leucodistrofia Metacromática Brasil- stefanofrb@gmail.com
- Sempre a disposição
Equipe
- Anna Clara Ries Winck, estudante de medicina - Anna Thereza Casteli Piovesan, estudante de Medicina - Danielle Roberta Tomasi, estudante de Medicina - Gabrielly Caponi Hansen, estudante de medicina. - Gabriella Zanin Fighera, estudante de medicina - Jayana Teixeira Maciel, estudante de medicina. - Julia Cavaler Vitali, estudante de medicina - Júlia Dobler, estudante de medicina - Josimara Luiza Parise, estudante de medicina - Laíse Pauletti Barp, estudante de medicina - Laura Delai, estudante de medicina - Luiza Ranzi da Costa, estudante de medicina. - Marina Frosi Amaral, estudante de medicina - Monique Sartori Broch, estudante de medicina - Rafaela Zell, estudante de medicina - Bibiana Mello de Oliveira, médica geneticista